Cinci flori care îmbunătățesc...
Doza de sănătate
Boli și Afecțiuni
Lifestyle
Evenimente
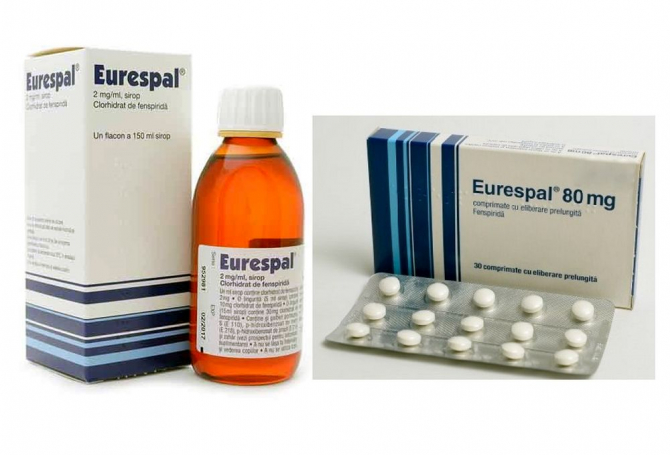
„Până la următoarele comunicări, vă rugăm să blocați de la vânzare toate loturile de EURESPAL 80 gm x 30 cpr și EURESPAL SIROP 2 mg / ml 150 ml și să anunțați clienții dumneavoastră, conform deciziei deținătorului Aurotizației de Punere pe Piață a produselor. În cel mai scurt timp vă vom transmite planul de acțiune avizat de ANMDM", se arată în mesajul transmis unor farmacii și medici de familie.
Pe site-ul Agenției Naționale a Medicamentului și a Dispozitivelor Medicale, însă, până în această dimineață nu fusese postat niciun anunț oficial de retragere a medicamentului în cauză.
Decizia de retragere a acestuia a fost luată după ce Agenția Naționala de Securitate a Medicamentului din Franța (ANSM) a emis o alertă în țara respectivă.
Medicamentul - atât siropul, cât și comprimatele - a fost scos de la vânzare în Franța, după ce a fost publicat un nou studiu care a scos la iveală că substanța din acest medicament poate provoca afecțiuni cardiace.
Eurespal se vinde sub această denumire și în Georgia, Bulgaria, Polonia și Rusia, în timp ce în Franța era comercializat sub numele de Pneumorel.
Într-o informare destinată medicilor generaliști, otolaringologilor (ORL), pneumologilor, cardiologilor, pediatrilor, geriatrilor și farmaciștilor, Agenția Naționala de Securitate a Medicamentului din Franța atrage atenția că „Laboratoires Servier vă informează despre suspendarea autorizațiilor de introducere pe piață (MA) și retragerea de pe piață a medicamentelor care conțin fenspiridă (Pneumorel 80 mg, comprimat filmat și Pneumorel 0,2%, sirop) 2019, ca urmare a rezultatelor unor noi studii non-clinice de siguranță".
- Pentru a asigura siguranța pacienților, ANSM a decis suspendarea autorizațiilor de introducere pe piață pentru medicamentele pe bază de fenspiride.
- Această decizie vine ca urmare a concluziilor unor studii noi, non-clinice, care sugerează că aceste medicamente pot prelungi intervalul QT (Intervalul QT este o măsurătoare efectuată pe o electrocardiogramă, utilizată pentru a evalua unele dintre proprietățile electrice ale inimii, n.r.)
- Medicamente care conțin fenspiridă nu mai sunt disponibile începând cu data de 8 februarie 2019 și o rechemare în lot a fost pusă în aplicare la acea dată.
- Medicii sunt rugați să nu mai prescrie sau să nu mai elibereze aceste medicamente.
Pacienții trebuie să-și întrerupă tratamentul și să ducă la farmacie medicamentele pentru a fi distruse, se mai arată în informarea dată de francezi.
Potrivit unui anunț al Agenției Europene a Medicalentului (EMA), producătorului i s-a cerut ca, până la 27 februarie 2019, să introducă pe prospect următoarele reacții advarese:
- Următoarele reacții adverse trebuie adăugate la tulburările gastro-intestinale.
Frecvență necunoscută: Disgeuzia (modificarea gustului alimentelor, n.r.)
- Următoarele reacții adverse trebuie adăugate la tulburările sistemului nervos
frecvență necunoscută: Cefalee (care este o durere resimțită la nivelul capului, meningelui, învelișului creierului, care poate poate cuprinde nivelul feţei, al gâtului etc., n.r.)
- Următoarele reacții adverse trebuie adăugate sub SOC respirator, toracic:
Tulburări mediastinale cu frecvență necunoscută: Dispnee
EMA notează că următoarele reacții adverse trebuie adăugate la:
Secțiunea 4
- Tulburări ale gustului,
- Durere de cap,
- Creșterea tensiunii arteriale,
- Dificultăți de respirație.
Fiți la curent cu ultimele noutăți. Urmăriți DCMedical și pe Google News
Te-a ajutat acest articol?
Urmărește pagina de Facebook DCMedical și pagina de Instagram DCMedical Doza de Sănătate și accesează mai mult conținut util pentru sănătatea ta, prevenția și tratarea bolilor, măsuri de prim ajutor și sfaturi utile de la medici și pacienți.
Cinci flori care îmbunătățesc...
Eritritolul, un îndulcitor prezent...
De ce să scoți aparatele...
Un raport european recent trage un...
Cea mai mare greșeală pe care o faci...
Cum să albim prosoapele albe și să...
Obiceiul zilnic care reduce stresul...
Te trezești brusc noaptea? Ar putea...